Des plantes et des animaux pour fabriquer des molécules

La moléculture (ou « culture de molécules ») est l’utilisation de plantes ou d’animaux génétiquement modifiés [1] pour qu’ils produisent des molécules, notamment à but thérapeutiques. Une solution d’avenir ? Pas si sûr…
De nombreuses plantes génétiquement modifiées (PGM) destinées à la moléculture ont été expérimentées en champs. En France, le cas le plus emblématique a été l’essai mené, en 2005, par l’entreprise privée Meristem Therapeutics (dont Limagrain était alors un des actionnaires importants) avec un maïs transgénique qui produisait de la lipase gastrique, molécule utilisée pour soulager certains effets secondaires de la mucoviscidose. Réalisé sur 3 000 m², cet essai a été détruit en 2005 par les Faucheurs volontaires. En France, Meristem a aussi testé en champs deux autres maïs « thérapeuthiques ». Le président du directoire de Meristem annonçait dans Le Monde, en 2005, que le marché de la lipase « représente une centaine de millions d’euros par an. Notre rôle sera de fournir la protéine à un partenaire pharmaceutique qui fabriquera le médicament ». Un millier d’hectares de maïs OGM étaient prévus.
D’autres plantes transgéniques ont été cultivées pour produire d’autres molécules d’intérêt médical : albumine humaine, lactoferrine, vaccins, anticorps, et encore très récemment (septembre 2014), des molécules pour lutter contre le virus Ebola.
Concrètement, très peu de médicaments produits par des plantes ou des animaux transgéniques ont reçu une homologation, au niveau international. L’Union européenne (UE) a ainsi par exemple autorisé, en 2006, la commercialisation de l’Atryn, protéine anticoagulante recombinante humaine (antithrombine) issue du lait de chèvre transgénique. En revanche, l’élevage desdites chèvres n’est pas autorisé dans l’UE. D’autres animaux ont été autorisés aux États-Unis. Ainsi, fin 2015, l’entreprise Alexion Pharmaceuticals a été autorisée à commercialiser des poules génétiquement modifiées qui produisent, dans leurs œufs, une enzyme humaine recombinante, la sebelipase alfa.
À notre connaissance, aucun médicament produit par des plantes cultivées en champs ou sous serre n’est autorisé au niveau mondial. Mais l’Agence européenne du médicament n’a pas souhaité confirmer cette information à Inf’OGM.
Un avantage économique controversé
L’argument est essentiellement économique : la capacité des plantes GM pour produire des protéines recombinantes est plus importante et moins coûteuse que celle des micro-organismes. En effet, ces systèmes de production à l’échelle de l’organisme entier autorisent leur promoteur à s’affranchir de la structure de confinement et des aspects coûteux et contraignants des cultures cellulaires dans le cas des cellules animales. Toutefois, le calcul est biaisé car il ne tient pas compte des coûts environnementaux, sanitaires et sociaux qu’entraînerait une contamination par une production non confinée, en champ ou dans un élevage. Concernant la lipase gastrique, d’autres cellules seraient capables de fabriquer directement des protéines opérationnelles : levure de boulangerie, cellules d’ovaires de hamster…
Meristem Therapeutics affirmait qu’un hectare de maïs GM permettait de produire un kilo de lipase gastrique, soit un taux de production de lipase par pied relativement faible. Or, purifier une protéine peu abondante à partir d’un mélange protéique très riche dans un organisme pluricellulaire complexe qu’est le maïs aurait engendré des coûts élevés. Produite par une plante, la protéine nécessite, pour être opérationnelle, des modifications post-traductionnelles, c’est-à-dire des modifications chimiques, réalisées le plus souvent par une enzyme, après sa synthèse. Mais si on produit cette lipase via des bactéries ou des levures GM, le coût des modifications post-traductionnelles in vitro nécessaires devrait être compensé par l’économie faite sur la purification. Gérard Branlard, chercheur à l’Inra de Clermont-Ferrand-Theix, confirmait en 2005 qu’ « une telle quantité est obtenue de manière classique aujourd’hui à partir d’un micro-organisme surexprimant une molécule d’intérêt thérapeutique dans un biofermenteur ; cela en toute légalité, sans risque de contamination pollinique et pouvant fonctionner chaque jour de l’année car non tributaire du cycle annuel de la plante ». Car, de plus, les plantes sont aussi dépendantes des aléas climatiques…
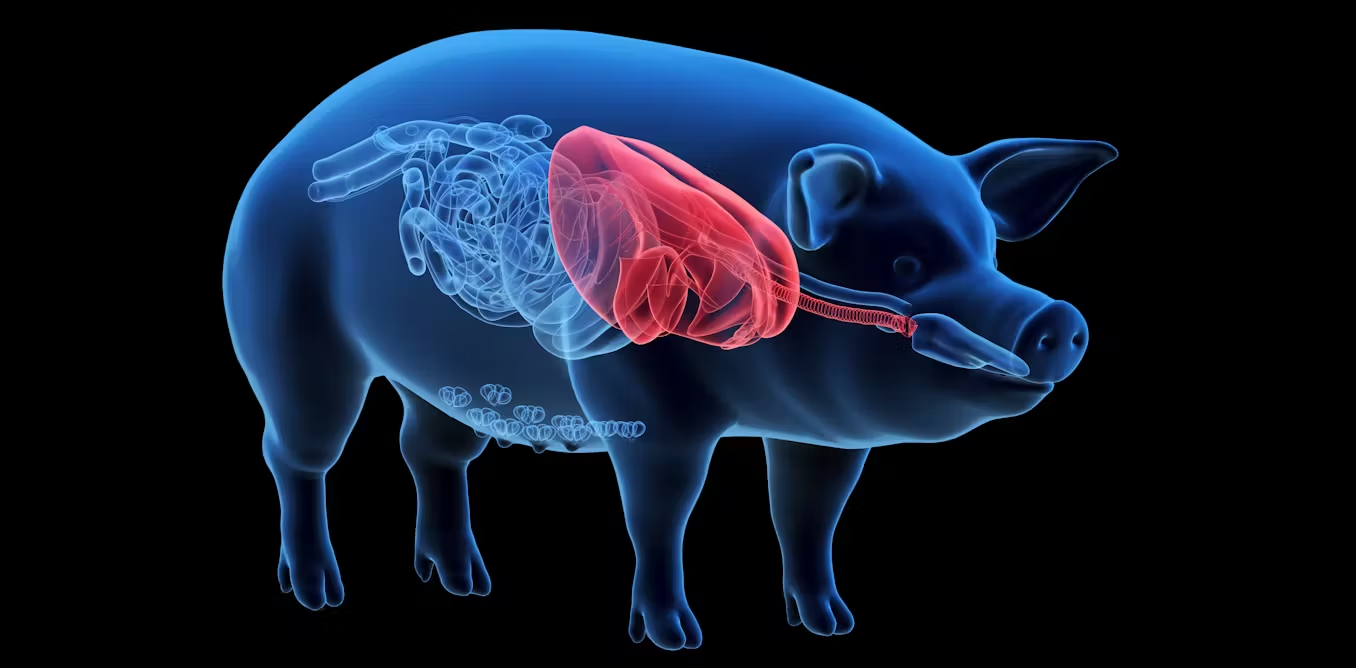
Pour les animaux transgéniques, un autre avantage a souvent été mis en avant : la facilité de la récolte quand la protéine est produite dans le lait d’un mammifère. Les modifications post-traductionnelles des protéines sont similaires à celles opérées dans le corps humain. En revanche, le risque de propagation de virus est problématique chez les animaux mais n’existe pas dans le cadre des PGM. Et comme nous le précise Christian Vélot, généticien, « la difficulté liée à la production de telles molécules par des animaux transgéniques réside dans la séparation de la protéine d’intérêt de celles de l’animal, avec à nouveau un risque de contamination croisée conduisant à la présence de pathogènes au sein des protéines produites » [2].
De nombreuses conséquences négatives
La moléculture a comme premier défaut de mobiliser des terres agricoles pour un usage autre que la production alimentaire. Or, les terres fertiles se raréfient (urbanisation, salinisation, etc.). Étant donné qu’il n’est ni réellement possible, ni souhaitable de domestiquer l’ensemble des milieux, il semble pertinent, comme le recommande notamment le rapporteur des Nations unies pour le droit à l’alimentation, de consacrer les terres arables à l’agriculture.
Ensuite, cultiver à l’air libre des PGM productrices de molécules thérapeutiques ou industrielles ne peut qu’entraîner leur dissémination incontrôlable. Or, du fait de leur nature, ces molécules ne doivent pas se retrouver dans des cultures destinées à l’alimentation humaine. Plusieurs exemples montrent que le risque de contamination n’est pas virtuel. En 2002, l’entreprise étasunienne Prodigen a été condamnée à une lourde amende pour mauvaise gestion d’un essai en champs de maïs transgénique produisant des molécules pharmaceutiques, lequel a contaminé des productions destinées à l’alimentation humaine. Plus récemment, en 2009, en Islande, suite à la destruction d’une parcelle d’orge transgénique « en plein air » destinée à la production d’une hormone de croissance humaine, l’entreprise Orf Genetics a transféré ses expérimentations en serre… Mais ces serres laissent à désirer quant aux mesures de sécurité : pas de double paroi, ni de sol cimenté, ni de sas stérile. Et récemment, un coup de vent violent a détruit l’une de ces serres et disséminé les PGM dans l’environnement.
S’ajoute la question du transfert horizontal de gènes, un processus dans lequel un organisme intègre du matériel génétique provenant d’un autre organisme sans en être le descendant. Les entreprises ont tendance à minimiser ce risque, qui n’a été que très peu étudié. Et quand il l’est, c’est souvent en laboratoire, ce qui entraîne une sous-estimation de son occurrence. En effet, par exemple, après récolte, les parties de plantes restantes sont en général broyées et enfouies dans le sol, ce qui augmente considérablement l’accessibilité des micro-organismes du sol à l’ADN végétal, et donc les risques de transferts horizontaux.
Et si on prenait des cellules de plantes ?
L’alternative serait alors peut-être dans la production de ces protéines par des cellules de plantes en milieu confiné. Selon un article publié dans la revue Nature Biotechnology, « l’avantage sans doute le plus important des cellules de plantes par rapport à la plante entière est la procédure beaucoup plus simple de purification du produit, tout particulièrement quand ce produit est sécrété dans le milieu de culture ». Et plus loin : « Contrairement aux plantes en plein champ, la performance des cultures de cellules de plantes est indépendante du climat, de la qualité du sol, des saisons, de la longueur du jour et du temps [et] il n’y a aucun risque de contamination avec des mycotoxines, des herbicides ou des pesticides ».
[1] Les micro-organismes (levure, bactérie, cellule de mammifère, etc.) ont aussi été génétiquement modifiés pour produire des molécules en fermenteur (ou incubateurs). Mais les problématiques sociales sont tellement différentes qu’il est important de les présenter et de les penser séparément, voir , « Des OGM au service de la santé humaine ? », Inf’OGM, 1er mars 2018
[2] , « Génétique humaine : du soin au bébé parfait », Inf’OGM, 3 janvier 2018