Actualités
UE – Les autorisations d’OGM sont-elles légales ?

Quatrième et dernier volet de notre série sur le suivi des demandes d’autorisations de plantes génétiquement modifiées (PGM) déposées entre octobre 2016 et fin décembre 2017 : quelle légalité des décisions d’autorisations délivrées par la Commission européenne ? Ces décisions concernent 34 plantes transgéniques destinées à l’importation et l’alimentation humaine et/ou animale. Des décisions dont plusieurs sont le fruit de procédures de gestion allégées et révèlent des incohérences quant à l’évaluation scientifique.
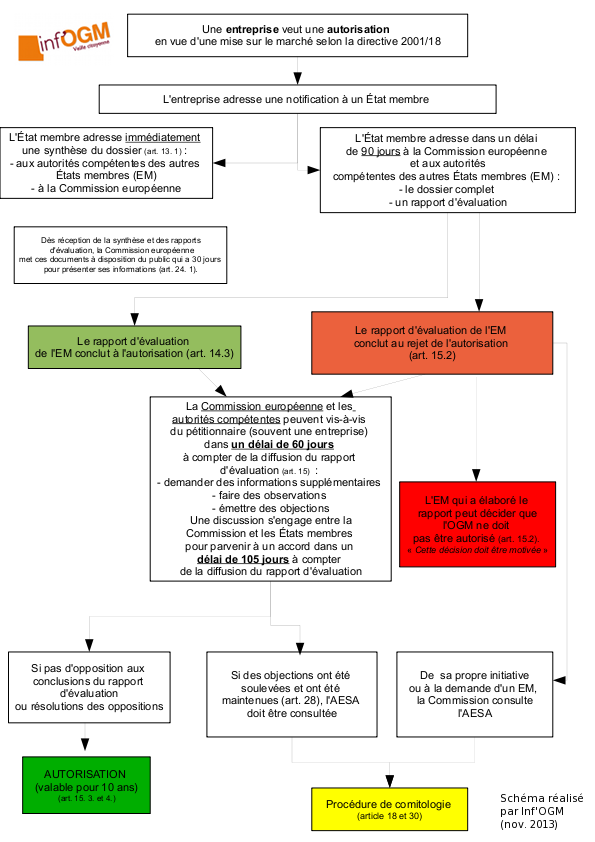
Après avoir été étudiées par les comités d’experts européens et nationaux, les PGM doivent faire l’objet d’une décision politique d’autorisation avant de pouvoir être commercialisées. Dans l’Union européenne, ces décisions sont délivrées par les États membres, sur proposition de la Commission européenne. Et si les États membres n’arrivent pas à se mettre d’accord, la Commission européenne a le dernier mot. C’est ainsi que 100 % des décisions d’autorisation prises entre octobre 2016 et fin décembre 2017 l’ont été par la Commission européenne.
Douze décisions pour autoriser 34 PGM
En trois réunions, 12 décisions ont été adoptées et 34 PGM autorisées (toutes destinées à l’importation, à l’alimentation humaine et animale).
Le 22 novembre 2016, la Commission européenne autorisait un œillet transgénique SHD-27531-4 de l’entreprise Suntory, modifié par transgenèse pour avoir une couleur modifiée [1] [2].
Le 4 juillet 2017, la Commission européenne se montrait plus productive : cinq décisions ont été prises pour autoriser 25 PGM [3]. Une des autorisations accordées ce jour-là concernait en effet un maïs à cinq transgènes (le maïs Bt11*59122*Mir604*1507*GA21) et ses vingt sous-combinaisons (les plantes ayant deux, trois ou quatre de ces transgènes).
Enfin, le 21 décembre 2017, six décisions ont été prises et huit plantes transgéniques autorisées (étant donné qu’une décision concernait une plante empilée et deux sous-combinaisons) [4].
Comme Inf’OGM l’a déjà rapporté [5] [6], toutes ces PGM n’ont pas été évaluées de la même manière par les experts européens et les experts français. Nombre d’entre elles ont reçu un avis défavorable en France du fait du manque de données ou de données interprétées de manière erronées par le pétitionnaire. Mais les experts européens ont, de leur côté, conclu à une absence de risque des sous-combinaisons de plantes empilées sans aucune donnée fournie par les entreprises. Une conclusion « scientifique » qui a ouvert la voie à l’autorisation réglementaire de ces PGM.
Un seul dossier pour vingt PGM…
Pour comprendre cet aspect réglementaire de l’autorisation délivrée par la Commission européenne pour le maïs empilé Bt11*59122*Mir604*1507*GA21 et ses vingt sous-combinaisons, il faut se replonger dans un règlement européen adopté en 2013. Ce règlement prévoit que, pour toute demande d’autorisation d’une PGM à plusieurs transgènes (plantes empilées), destinée à l’alimentation humaine et/ou animale et déposée après 2013, « la demande doit porter sur chaque sous-combinaison qui n’a pas encore été autorisée, quelle qu’en soit l’origine » [7].
Selon ce règlement, la mise en culture d’un maïs à cinq transgènes peut donner, au moment de la récolte, aussi bien des épis ayant les cinq transgènes que des épis en ayant quatre, trois, deux, un… Dès lors, « la concordance des autorisations et des produits dont la mise sur le marché est inévitable […] commande que les demandes relatives à des denrées alimentaires et aliments pour animaux génétiquement modifiés issus de cultures avec ségrégation portent sur chaque sous-combinaison, quelle qu’en soit l’origine ». Dont acte législatif.
Pourquoi le règlement précise que cela est valable « quelle qu’en soit l’origine » ? Cette précision nous étonne car l’origine des sous-combinaisons est donnée par… le règlement lui-même : ce sont « les denrées alimentaires et aliments pour animaux génétiquement modifiés qui [sont, contiennent ou sont produits à partie de PGM empilées] dont la culture est associée à la production de matériel génétiquement modifié contenant plusieurs sous-combinaisons d’événements de transformation (culture avec ségrégation) ». Il s’agit donc des sous-combinaisons produites par culture, pas d’origine inconnue. Mais la décision délivrée le 4 juillet 2017 par la Commission européenne concerne le maïs Bt11*59122*Mir604*1507*GA21 de Syngenta et ses vingt sous-combinaisons, sans précision d’une origine au champ de ces sous-combinaisons…
La Commission se contente de peu
Néanmoins, les annexes de la décision détaillent « une condition spécifique »… La Commission européenne prend en effet soin de préciser que le pétitionnaire devra « rassembler des informations sur les niveaux d’expression des protéines nouvellement exprimées » au cas ou une des sous-combinaisons devrait « être créée selon une approche de reproduction ciblée et commercialisée ». Une condition spécifique donc qui permet à la Commission européenne de délivrer une autorisation commerciale pour un maïs à cinq événements de transformation et 20 sous-combinaisons, sous-combinaisons qui ne sont pas passées par la case de l’évaluation des risques.
Et pour cause, la Commission européenne écrit dans cette même décision que les experts européens de l’Agence européenne de sécurité des aliments (AESA/EFSA) n’ont constaté « aucun problème de sécurité […] pour les 20 sous-combinaisons faisant l’objet de la demande ». Une formule bien rapide qui passe sous le silence que si l’AESA n’a constaté « aucun problème de sécurité », c’est qu’elle n’avait aucune donnée scientifique fournie. Quoi de mieux en effet pour ne pas constater que de ne pas regarder… Néanmoins, l’AESA a également recommandé que « le pétitionnaire devrait fournir toute information pertinente si ces sous-combinaisons devaient être […] importées dans l’Union européenne dans le futur ».
Autoriser sans aucune donnée scientifique, est-ce légal ?
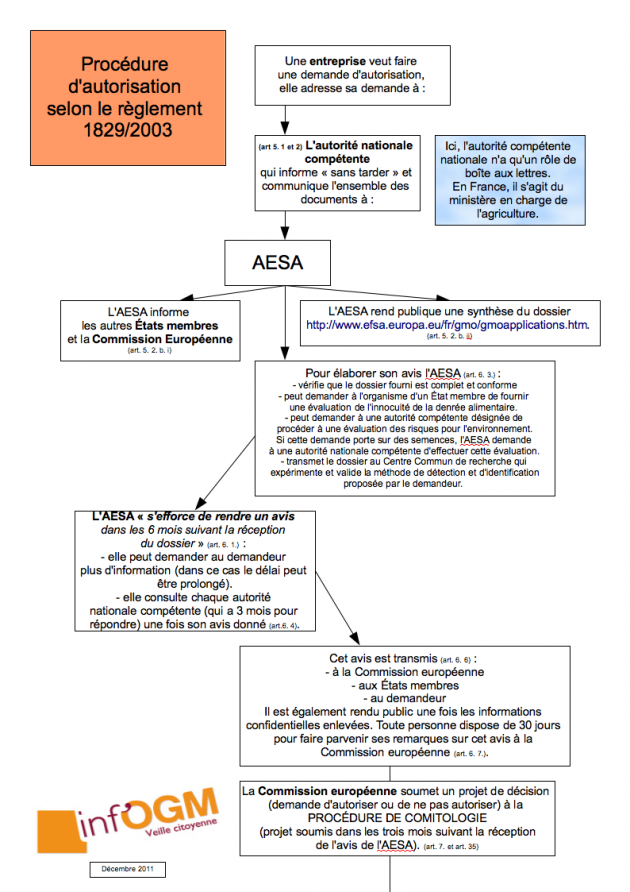
Si le règlement 1829/2003 cadre la procédure d’autorisation, depuis 2013, c’est le règlement 503/2013 qui en définit une partie du contenu. Or, ce règlement 503/2013 stipule que « pour les denrées alimentaires et aliments pour animaux génétiquement modifiés qui consistent en plantes génétiquement modifiées, en contiennent ou sont produits à partir de plantes de ce type et dont la culture est associée à la production de matériel génétiquement modifié contenant plusieurs sous-combinaisons d’événements de transformation (cultures avec ségrégation), la demande doit porter sur chaque sous-combinaison qui n’a pas encore été autorisée, quelle qu’en soit l’origine ». Autrement dit, chacune des sous-combinaisons d’événements de transformation est considérée comme un OGM spécifique au sens du règlement 1829/2003 [8]. Toutes ces sous-combinaisons doivent donc suivre la procédure prévue par le règlement 1829/2003, qui impose qu’une autorisation d’OGM n’est donnée que s’il est démontré de manière adéquate et suffisante que la denrée ou l’aliment GM n’a pas d’effets négatifs sur la santé humaine, la santé animale ou l’environnement [9]. Un requis confirmé par la Cour de l’Union européenne en décembre 2016 [10].
Si le règlement 1829/2003 requiert que « la mise sur le marché de denrées alimentaires et d’aliments pour animaux génétiquement modifiés ne [soit] autorisée qu’après une évaluation scientifique, du plus haut niveau possible, des risques », le règlement 503/2013 prévoit lui que ces sous-combinaisons puissent être autorisées sans qu’aucune donnée scientifique n’ait été fournie. Mais pour cela, « le demandeur doit étayer par une motivation scientifique l’inutilité de fournir des données expérimentales à propos des sous-combinaisons concernées », à défaut de quoi le même demandeur doit « fournir ces données expérimentales » [11].
Il est enfin utile de rappeler que dans l’Union européenne, le principe de précaution constitue un principe général du droit. Et ce principe a été interprété par la Cour de l’Union européenne [12]. Il implique que, lorsque des incertitudes subsistent quant à des risques sanitaires, des mesures de protection peuvent être prises sans avoir à attendre que la réalité et la gravité de ces risques soient pleinement démontrées.
L’avis des experts de l’AESA concernant le maïs Bt11*59122*Mir604*Ga21*1507 était énoncé ainsi : « pour les vingt sous-combinaisons, le panel OGM de l’AESA a suivi une approche du poids de l’évidence et a conclu qu’il était attendu qu’elles soient aussi sûres que le maïs à cinq évènements empilés. Aucune donnée n’a été fournie pour les sous-combinaisons » [13]. La Commission pouvait-elle alors en conclure qu’aucun problème de sécurité n’a été constaté ? Et que toutes les incertitudes ont été levées, conformément au principe de précaution ? Sur le plan scientifique, un membre de l’AESA, Jean-Michel Wal, précise dans une opinion minoritaire que l’entreprise s’est contentée d’envoyer à la Commission européenne une lettre présentant « une compilation de considérations générales de différente nature pour prétendre que les données manquantes n’étaient pas nécessaires pour l’évaluation des risques »…
Sur le plan légal, cela pourrait bien ressembler à une omission d’argumentaire scientifique justifiant de ne pas soumettre les données. Et sur le plan personnel, à chacun de se faire son opinion mais retenons que cette manière de gérer les demandes d’autorisation va se répéter comme c’est par exemple déjà le cas avec le dossier du maïs Mon87427*Mon89034*Nk603 et trois sous-combinaisons [14]…
Au cas où : demande de réexamen interne des décisions d’autorisation
Les décisions d’autorisations d’OGM peuvent faire l’objet d’un recours en annulation, difficile néanmoins à mettre en œuvre [15]. Mais les organisations non gouvernementales peuvent aussi adresser à la Commission européenne une demande de réexamen d’une décision d’autorisation de mise sur le marché d’OGM, sur le fondement du règlement d’Aarhus [16]. L’objet de la demande de réexamen interne est d’obtenir la réévaluation de l’autorisation de mise sur le marché des produits concernés (et non d’obtenir son annulation).
Dans un arrêt du 15 décembre 2016, la Cour de l’Union européenne a en effet reconnu que les décisions prises dans le cadre du règlement 1829/2003 faisaient partie des matières du droit de l’environnement visées par le règlement Aarhus et pouvaient donc faire l’objet d’une demande de réexamen interne. L’un des intérêts de la demande de réexamen interne est qu’elle peut être introduite à l’encontre de décisions d’autorisation d’OGM qui ne peuvent plus faire l’objet de recours en annulation (parce que le délai de recours est expiré et donc que l’acte est devenu définitif).
[1] , « Oeillet SHD-27531-4 », Inf’OGM, 22 novembre 2016
[2] Décision 2016/2050 du 22 novembre 2016 selon la procédure 2001/18
[3] Décision 2017/1209 du 4 juillet 2017 selon la procédure 1829/2003 pour le maïs Bt11*59122*Mir604*1507*GA21 et vingt sous-combinaisons (Bt11*Mir604*1507*Ga21 – Bt11*59122*1507*Ga21 – Bt11*59122*Mir604*Ga21 – Bt11*59122*Mir604*1507 – 59122*Mir604*1507*Ga21 – Bt11*59122*Mir604 – Bt11*59122*1507 – Bt11*59122*Ga21 – Bt11*Mir604*1507 – Bt11*1507*Ga21 – 59122*Mir604*1507 – 59122*Mir604*Ga21 – 59122*1507*Ga21 – Mir604*1507*Ga21 – Bt11*59122 – Bt11*1507 – 59122*Mir604 – 59122*Ga21 – Mir604*1507 – 1507*Ga21) ; décision 2017/1207 du 4 juillet 2017 selon la procédure 1829/2003 le maïs Mon810 ; décision 2017/1211 du 4 juillet 2017 selon la procédure 1829/2003 pour le coton 281-24-236*3006-210-23*Mon88913 ; décision 2017/1208 du 4 juillet 2017 selon la procédure 1829/2003 pour le coton GHB119 et décision 2017/1212 du 4 juillet 2017 selon la procédure 1829/2003 pour le maïs DAS40278-9.
[4] Décision 2017/2448 du 21 décembre 2017 selon la procédure 1829/2003 pour le soja 305423 × 40-3-2 ; décision 2017/2453 du 21 décembre 2017 selon la procédure 1829/2003 pour le colza MON 88302 × Ms8 × Rf3 et deux sous-combinaisons (MON 88302 × Ms8 et MON 88302 × Rf3) ; décision 2017/2452 du 21 décembre 2017 selon la procédure 1829/2003 pour le maïs 1507 (renouvellement) ; décision 2017/2449 du 21 décembre 2017 selon la procédure 1829/2003 pour le soja DAS-68416-4 ; décision 2017/2451 du 21 décembre 2017 selon la procédure 1829/2003 pour le soja FG72 × A5547-127 ; décision 2017/2450 du 21 décembre 2017 selon la procédure 1829/2003 pour le soja DAS-44406-6.
[5] , « OGM : divergence chez les experts français et européens », Inf’OGM, 26 décembre 2017
[6] , « OGM : les entreprises ne jouent pas franc jeu », Inf’OGM, 29 décembre 2017
[7] Annexe II, point 2.2 du règlement 503/2013. http://eur-lex.europa.eu/legal-content/FR/TXT/?qid=1513843138430&uri=CELEX:32013R0503
[8] article 3, paragraphe 1, et article 15, paragraphe 1 du règlement 1829/2003
[9] article 4 paragraphe 3 et article 16 paragraphe 3 du règlement 1829/2003.
[10] Arrêt dans l’affaire T-177/13 Testbiotech e.a./Commission.
[11] Règlement 503/2013, annexe II, point 2, paragraphe 2.2
[12] arrêt du 9 septembre 2003, Monsanto Agricoltura Italia e.a., C-236/01, point 111
[13] , « Maïs Bt11*59122*Mir604*1507*GA21 et 20 sous-combinaisons », Inf’OGM, 4 juillet 2017
[14] , « Maïs MON87427*MON89034*NK603 et 3 sous-combinaisons », Inf’OGM, 3 août 2018
[15] article 2683, alinéa 4 du TFUE
[16] règlement 1367/2006, article 10